2020年5月,醫(yī)療器械CE認(rèn)證法規(guī)將開始在歐盟申請(法規(guī)(EU)2017/745),該法規(guī)于2017年生效,并廢除了之前的現(xiàn)行指令。它意味著對公司的新要求并涵蓋更多產(chǎn)品,因此,在這個新的截止日期臨近時,謹(jǐn)慎是至關(guān)重要的。
新的醫(yī)療器械法規(guī)?
1、范圍更廣
隨著新的醫(yī)療器械法規(guī)在歐盟生效,現(xiàn)在涵蓋了更多的產(chǎn)品。具有非醫(yī)療目的的醫(yī)療器械現(xiàn)在屬于法規(guī)范圍。
具有美學(xué)目的的這些裝置列于該法規(guī)的附件XVI中,并且可能在臨界產(chǎn)品方面存在問題(在兩個法規(guī)之間)。這些附件XVI產(chǎn)品可以是例如強(qiáng)脈沖光設(shè)備,乳房假體,或甚至具有美學(xué)目的的隱形眼鏡。
其他法規(guī)之間也存在邊界產(chǎn)品。例如,可以考慮口腔護(hù)理產(chǎn)品,這取決于產(chǎn)品,醫(yī)療裝置或化妝品。我們即將發(fā)布一篇關(guān)于醫(yī)療器械臨界產(chǎn)品的文章,以便更容易識別。
2、新的分類規(guī)則
分類修改很重要,該規(guī)定將分類規(guī)則的數(shù)量從18個增加到22個,舊的指令I(lǐng)類設(shè)備現(xiàn)在可能被視為IIa類,具有這一新規(guī)定。預(yù)計(jì)截止日期和謹(jǐn)慎是必不可少的。
3、加強(qiáng)監(jiān)督
歐洲法規(guī)的主要目標(biāo)仍然是保護(hù)消費(fèi)者。在這里,它更具體地協(xié)調(diào)了設(shè)備安全方面的要求。
一個更好的市場預(yù)評估現(xiàn)在需要。為此,必須提供更多信息和數(shù)據(jù)。每個州的通知機(jī)構(gòu)現(xiàn)在都處于歐洲控制之下,保證每個州都有相同的要求標(biāo)準(zhǔn)。
上市后安全監(jiān)測也得到了改善。公司不僅需要定期報(bào)告設(shè)備安全性,而且還將在歐洲范圍內(nèi)實(shí)施新的監(jiān)控工具。
實(shí)際上,歐洲聯(lián)盟目前正在開發(fā)一個歐洲醫(yī)療設(shè)備數(shù)據(jù)庫--EUDAMED,它應(yīng)該在2020年3月25日之前投入使用。后者將允許經(jīng)營者來注冊自己和醫(yī)療設(shè)備,同時也集中臨床研究,警惕,市場監(jiān)管等。當(dāng)然,所有的數(shù)據(jù)將不會被公開。此數(shù)據(jù)庫將與唯一設(shè)備標(biāo)識符(或UDI)系統(tǒng)一起使用。UDI將由設(shè)備標(biāo)識符和生產(chǎn)單元標(biāo)識符組成。
截止日期和關(guān)鍵日期
該規(guī)定將于2020年5月26日起實(shí)施,其中準(zhǔn)指令以完整的形式廢除,但還有其他日期需要記住。這是一個快速摘要:
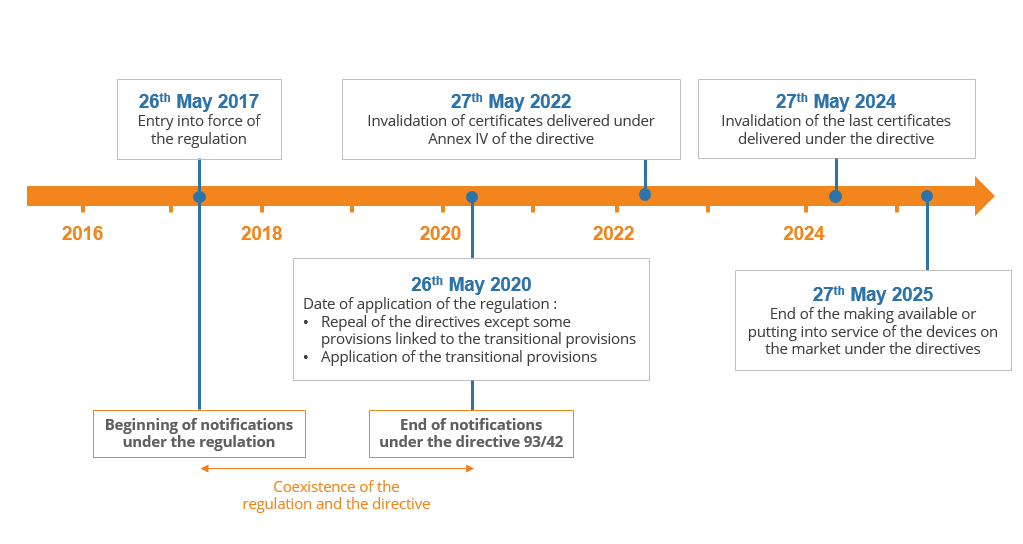
該法規(guī)的實(shí)施將持續(xù)數(shù)年:
1.在申請之日,即2020年5月,所有類別的設(shè)備都需要遵守該規(guī)定,
2.在2022年至2024年之間,根據(jù)指令交付的證書將失效,
3.2024年5月27日,由于最后證書無效,所有IIa至III類醫(yī)療器械必須遵守該規(guī)定,
4.根據(jù)該指令合法商業(yè)化的設(shè)備仍可在市場上銷售或投入使用,直至2025年5月27日。
我們的專家將負(fù)責(zé)處理從I級到IIa級的醫(yī)療設(shè)備的注冊。由于他們對這項(xiàng)新法規(guī)的深入了解,我們的專家會為您提供最佳預(yù)測未來期限的策略建議。
背景:為什么這個規(guī)定?
迄今為止,歐洲指令規(guī)定醫(yī)療器械的營銷可追溯到1990年,對于最老的醫(yī)療器械。作為指令,它們沒有直接適用性,因此必須轉(zhuǎn)換為每個州的國家立法。
因此,每個成員國都可以自由地解釋文本,從而在其應(yīng)用中產(chǎn)生差異。
一個監(jiān)管然而,有直接適用于所有成員國,并允許這個原因,統(tǒng)一的要求,關(guān)于醫(yī)療器械的銷售。
